Data:2020年11月02日 Click:0 Release:1
今天推荐一篇JACS的文章,通讯作者是香港城市大学的孙红燕,中科院高能物理研究所的胡毅,香港城市大学深圳研究院的王钻开和香港城市大学的何明亮。孙红燕课题组主要专注于利用高通量筛选技术鉴定生物活性肽,同时设计并合成基于肽的生物材料,用于控制给药和组织工程,此外还设计和合成荧光探针,用于各种生物分子的生物成像。

在活细胞内实现超分子的自组装目前已在细胞活性控制、药物递送或生物成像方面具有重要应用,但是在亚细胞定位条件下实现大分子自组装的例子还很少且很有挑战性。本文巧妙设计了一例含有琥珀酰化的多肽探针,利用定位于线粒体的SIRT5能够高效对其进行去琥珀酰化的能力,在活细胞水平实现了只在线粒体进行超分子自组装的设计,且这一策略通过荧光检测的方式首次实现了在活细胞中对SIRT5进行基于活性的成像。
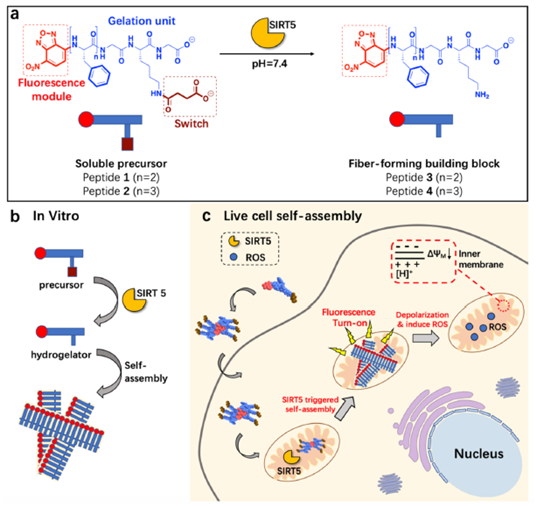
SIRT5属于III类NAD+依赖性组蛋白去乙酰化酶家族中的一员,定位在线粒体,具有高效的赖氨酸去乙酰化酶、脱丙二酸酶和脱氧戊脱谷氨酰酶活性,同时由于其参与到细胞的三羧酸循环、氧化应激和凋亡等途径因此目前也是很有前途的抗癌药物靶点之一。本文设计并合成了能够特异性响应SIRT5的多肽探针,同时也是大分子自组装的前体,探针主要由三部分构成:对环境敏感、用于成像的荧光团NBD,富含苯丙氨酸的多肽片段和一个被琥珀酰化的赖氨酸(Ksucc)。此前研究表明,NBD在疏水的纳米纤维环境中会发出强荧光;而富含苯丙氨酸的多肽片段则会在一定的条件下由于芳香性官能团的相互作用而形成自组装的纳米纤维;Ksucc则具有开关等多种作用,其羧酸基团能增加探针在水中的溶解度,Ksucc带的负电荷会产生静电斥力而减少自组装,此外,Ksucc还可特异性响应SIRT5。低分子量的探针扩散到细胞内后,会被定位在线粒体的SIRT5水解转化为带正电荷的赖氨酸残基,形成零电荷、带有两性离子的去琥珀酰化的肽段,由于这种独特的两性离子性质造成的静电相互作用和去琥珀酰化后肽段疏水性的进一步增强,这些去琥珀酰化的肽段就会在线粒体内形成自组装,从而产生纳米纤维。与此同时,由于纳米纤维中的疏水性,NBD将产生强烈的荧光,从而能够对活细胞中SIRT5的活性进行荧光检测或成像。
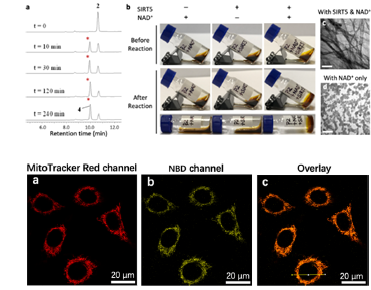
基于以上想法,作者设计并合成几种多肽探针,首先进行体外实验,发现0.005当量的SIRT5就能够高效使得探针peptide2去琥珀酰化,并形成水凝胶。随后,作者进行活细胞的实验,共聚焦显微镜的共定位实验,及细胞器分离后的电镜实验均表明探针peptide2只在hela细胞的线粒体中产生纳米纤维并发出强荧光,SIRT5抑制剂的使用或敲低表明这一现象是SIRT5依赖性的。
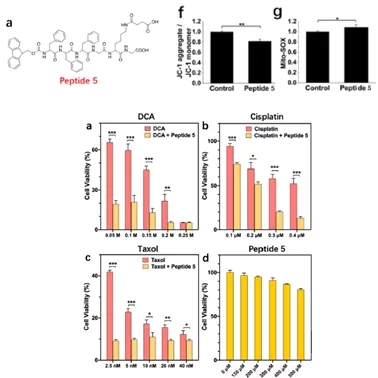
此外,作者还设计并合成了也能够形成线粒体内大分子自组装、但不带有荧光团的探针peptide5,用于研究其纳米纤维形成对线粒体及细胞的影响。发现此类探针会导致线粒体膜电位的去极化,还会促进ROS的形成,因此作者将此类多肽探针与三种不同的化疗药物共孵育,发现其显著提高了这些药物的抗癌活性。
综上所述,本文发展了一种线粒体定位的肽自组装的新策略,可用于SIRT5的活细胞成像,并具有潜在的抗癌治疗效果。
参与文献
原文链接:https://pubs.acs.org/doi/pdf/10.1021/jacs.0c08463
来源:王初课题组


