Data:2020年11月26日 Click:0 Release:1
在寻找和设计可以与重要的生物学靶标结合,尤其是可以识别大﹑平坦且不连续界面的蛋白质-蛋白质相互作用(PPI)的分子中,多肽化合物占有重要地位。但是,天然肽由于其固有的缺点(如对蛋白水解降解的敏感性)而被认为在治疗的应用性开发上还有缺陷。为了解决该问题,非天然序列的特异性拟肽或许可以成为可行的替代策略。对比天然多肽,拟肽不仅可以保留或模拟天然肽的折叠域,同时也显示出独特的结构和功能。例如,由于易于引入不同种类的侧链官能团,拟肽具有更丰富的化学多样性;非天然的骨架增加了酶解稳定性,从而使其生物利用度增加;此外,拟肽化合物可以模拟多肽和蛋白质的一级、二级和三级结构,并且可以通过合理的设计来提高它们在生物医学中的潜在应用。因此,开发新型的拟肽药物,具有重要的意义和前景。
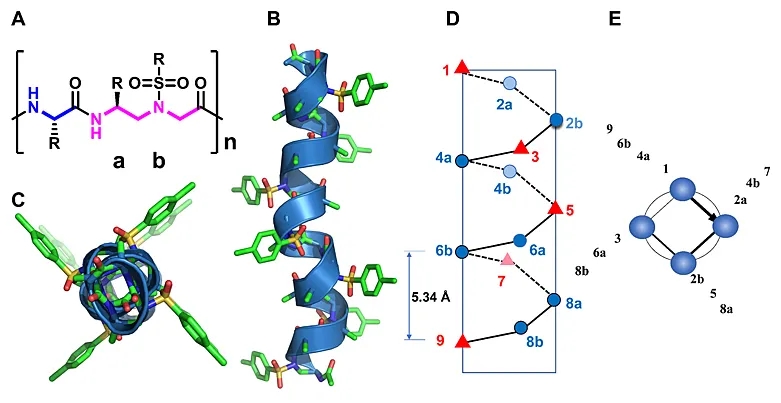
图1. 1:1杂化的α/Sulfono-γ-AA肽的化学和晶体结构。
2011年,南佛罗里达大学蔡健峰教授团队首次报道了一种新型拟肽γ-AApeptide。该拟肽基于手性PNA的骨架结构,通过引入不同的侧链取代基,使其兼具高度的酶解稳定性和化学多样性。十年来该团队一直致力于开发此类拟肽的功能和应用,并在2017年构造了γ-AApeptide的亚类——磺酰基-γ-AApeptide。已发现的磺酰基-γ-AApeptide肽具有一系列独特的二级螺旋结构,通过分子内氢键和磺酰胺基在分子骨架中的弯曲性质而稳定存在,且使得它们在溶液中极好的保持了类似α-螺旋折叠倾向。所以,磺酰基-γ-AApeptide 成为了可以模拟蛋白质的螺旋结构并破坏药物相关的PPI的理想候选物。在过去的两年中,该团队已成功的将具有414左手螺旋结构的磺酰基-γ-AApeptide应用于破坏多种α-螺旋介导的蛋白质-蛋白质相互作用中。但是,鉴于用左手螺旋模拟右手α-螺旋的局限性,他们也尝试使用具有右手螺旋结构的1:1杂化α/Sulfono-γ-AA Peptide参与阻断蛋白质-蛋白质相互作用。先前的结构研究表明1:1杂化的α/Sulfono-γ-AA肽采用稳定的右旋413风车形螺旋(图1),螺距为5.34 Å,这与α螺旋非常相似(螺距为5.4 Å),故而该类杂化拟肽可能会是潜在的抑制PPI的一类新型螺旋模拟物。为了验证这一设想,他们选择了p53-MDM2和p53-MDMX作为模板,通过模拟PPI结合的重要位点,以评估这一想法的可行性(图2),并采用细胞、体外实验与HSQC NMR相结合的手段评价该类1:1杂化α/Sulfono-γ-AAPeptide的活性。这一想法为今后更多蛋白质相互作用拟肽抑制剂的开发奠定了基础。
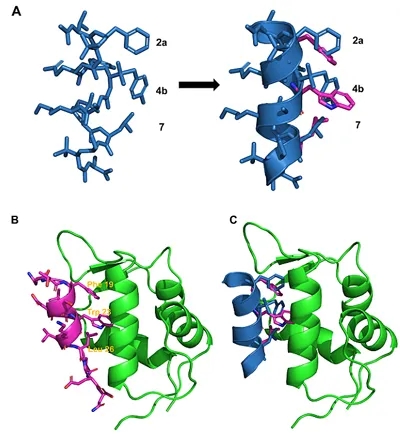
图2. p53 α-螺旋(紫色)与设计的1:1 α/Sulfono-γ-AA肽(蓝色)重叠图。
该成果近期发表在Journal of Medicinal Chemistry 上,由南佛罗里达大学蔡健峰教授团队、Moffitt癌症中心陈建东教授团队以及南佛罗里达大学Daughdrill教授团队共同完成。
参考文献
Rational Design of Right-Handed Heterogeneous Peptidomimetics as Inhibitors of Protein–Protein Interactions
Yan Shi, Peng Sang, Junhao Lu, Pirada Higbee, Lihong Chen, Leixiang Yang, Timothy Odom, Gary Daughdrill*, Jiandong Chen*, and Jianfeng Cai*
J. Med. Chem., 2020, 63, 13187–13196, DOI: 10.1021/acs.jmedchem.0c01638
来源:X一MOL资讯


